Minicerebros humanos implantados en ratones responden a estímulos visuales
Imagínese que partes del cerebro perdidas, deterioradas o enfermas pudieran volver a crecer en el laboratorio y trasplantarse para una nueva oportunidad de vida. Científicos de la Universidad de California en San Diego (UCSD) nos han acercado a esa realidad.

Los investigadores desarrollaron experimentos que combinan conjuntos de microelectrodos hechos de grafeno transparente e imágenes de dos fotones, una técnica de microscopía que puede obtener imágenes de tejidos vivos de hasta un milímetro de espesor. Crédito: David Bailot/UC San Diego.
Los organoides corticales humanos (o «minicerebros») trasplantados en ratones no solo se conectaron con el sistema vascular del huésped, sino que reaccionaron a los pulsos de luz que brillaban en los ojos de los sujetos de prueba de manera similar al tejido cerebral circundante.
Para determinar esto, los investigadores se valieron de innovadora tecnología que permitió mejoras en los implantes para medir y grabar señales neurológicas sutiles en una escala fina en el transcurso de varios meses.
«Prevemos que, más adelante, esta combinación de células madre y tecnologías de neurograbación se utilizará para modelar enfermedades en condiciones fisiológicas a nivel de circuitos neuronales, el examen de tratamientos candidatos sobre antecedentes genéticos específicos del paciente y la evaluación del potencial de organoides para restaurar regiones cerebrales específicas perdidas, deterioradas o dañadas», escribieron los autores.
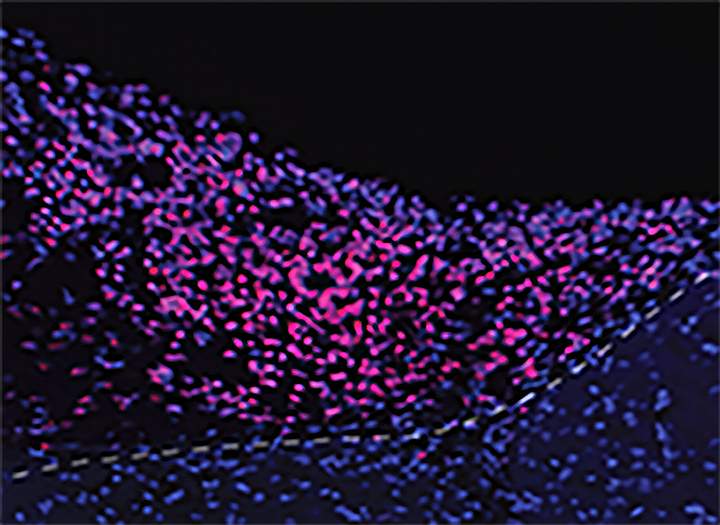
Los investigadores pudieron detectar y obtener imágenes del borde entre un organoide de cerebro humano trasplantado y el cerebro de un ratón. Crédito: Madison Wilson/UC San Diego.
El equipo de ingenieros y neurocientíficos, dirigido por Duygu Kuzum, desarrolló su nuevo sistema de registro para medir la actividad de las ondas cerebrales a nivel macro y micro al mismo tiempo.
La configuración utiliza microelectrodos flexibles y transparentes hechos de grafeno que se pueden implantar en ciertas partes del cerebro. Esta tecnología altamente afinada muestra con precisión los picos en la actividad neuronal tanto del organoide trasplantado como del tejido cerebral circundante a medida que ocurren.
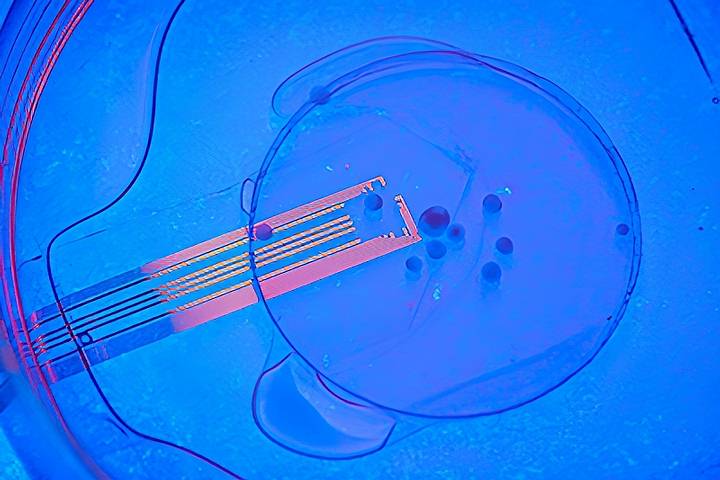
Los investigadores observaron actividad eléctrica en los canales de los electrodos por encima de los organoides, lo que demuestra que los organoides reaccionaban al estímulo de la misma manera que el tejido circundante. Crédito: David Bailot/UC San Diego.
Menos de un mes después del trasplante, los investigadores descubrieron que sus organoides humanos habían formado conexiones sinápticas funcionales con el resto de la corteza visual del ratón. Dos meses después, el tejido extraño se había integrado aún más con el cerebro del huésped.
Conectando minicerebros
Estudios previos, algunos realizados por los mismos autores en UCSD, han demostrado que los minicerebros humanos implantados en ratones pueden conectarse a los vasos sanguíneos que suministran oxígeno y nutrientes. Las neuronas también comienzan a madurar y autoorganizarse.
En 2019, por ejemplo, los científicos cultivaron células madre pluripotentes en una gota del tamaño de un guisante de dos millones de neuronas organizadas que sondearon su entorno en busca de conexiones vecinas.
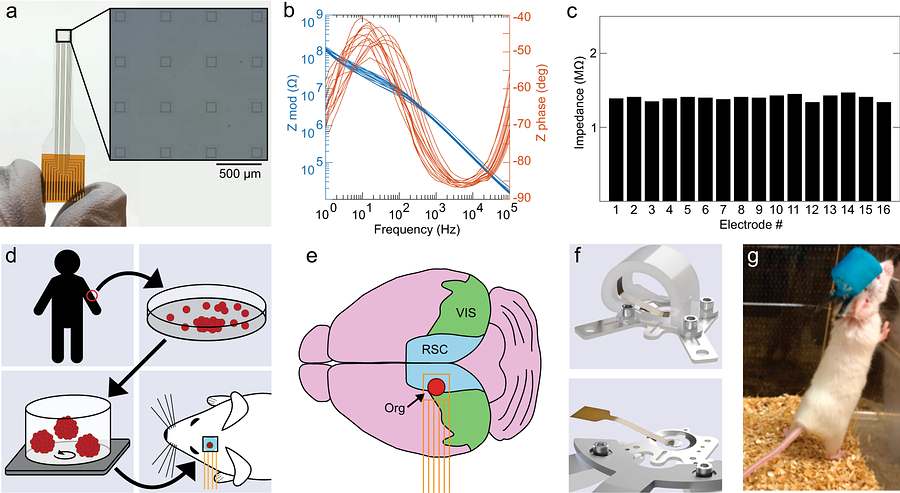
Generación de organoides y coimplantación con microelectrodos en corteza de ratón. Crédito: M.N. Wilson et al.
Las células madre pluripotentes también forman la base de los organoides del cerebro humano. Tienen el potencial de diferenciarse en una amplia variedad de tejidos y órganos, pero solo si están bañadas en el cóctel correcto de moléculas. Pero esa mezcla es increíblemente compleja y se basa en un momento muy específico, que los científicos aún están escudriñando.
En 2021, fue noticia un experimento donde un organoide cerebral comenzó a desarrollar estructuras oculares rudimentarias; si bien la viabilidad de lograr una «visión» funcional en un cerebro desarrollado en laboratorio aún está muy lejos.
Implantar un tejido cerebral humano cultivado a partir de células madre en una corteza visual desarrollada, por otro lado, podría ser un objetivo más realista. Los estudios han logrado esto antes en roedores, pero ha sido más difícil determinar si el injerto extraño está recibiendo activamente información funcional del resto del cerebro.
Los electrodos de metal convencionales no brindan un campo de visión claro al cerebro, lo que significa que los científicos tienen que quitar los electrodos para ver correctamente la corteza sensorial, y esto puede interferir con el éxito de un injerto de tejido.
Los electrodos transparentes ayudan a resolver ese problema. Usando una técnica de imágenes fluorescentes bajo el microscopio, los investigadores de la UCSD han demostrado por primera vez que los pulsos de luz pueden estimular los organoides humanos trasplantados dentro del cerebro de un ratón.
El estudio fue publicado en Nature Communications.





